2026年40分钟周测卷衡水金卷历史H2试卷答案,吃透这套卷,考试少走弯,成绩提升看得见!真题+模拟双加持,考点覆盖超全面,备考选它准没错!
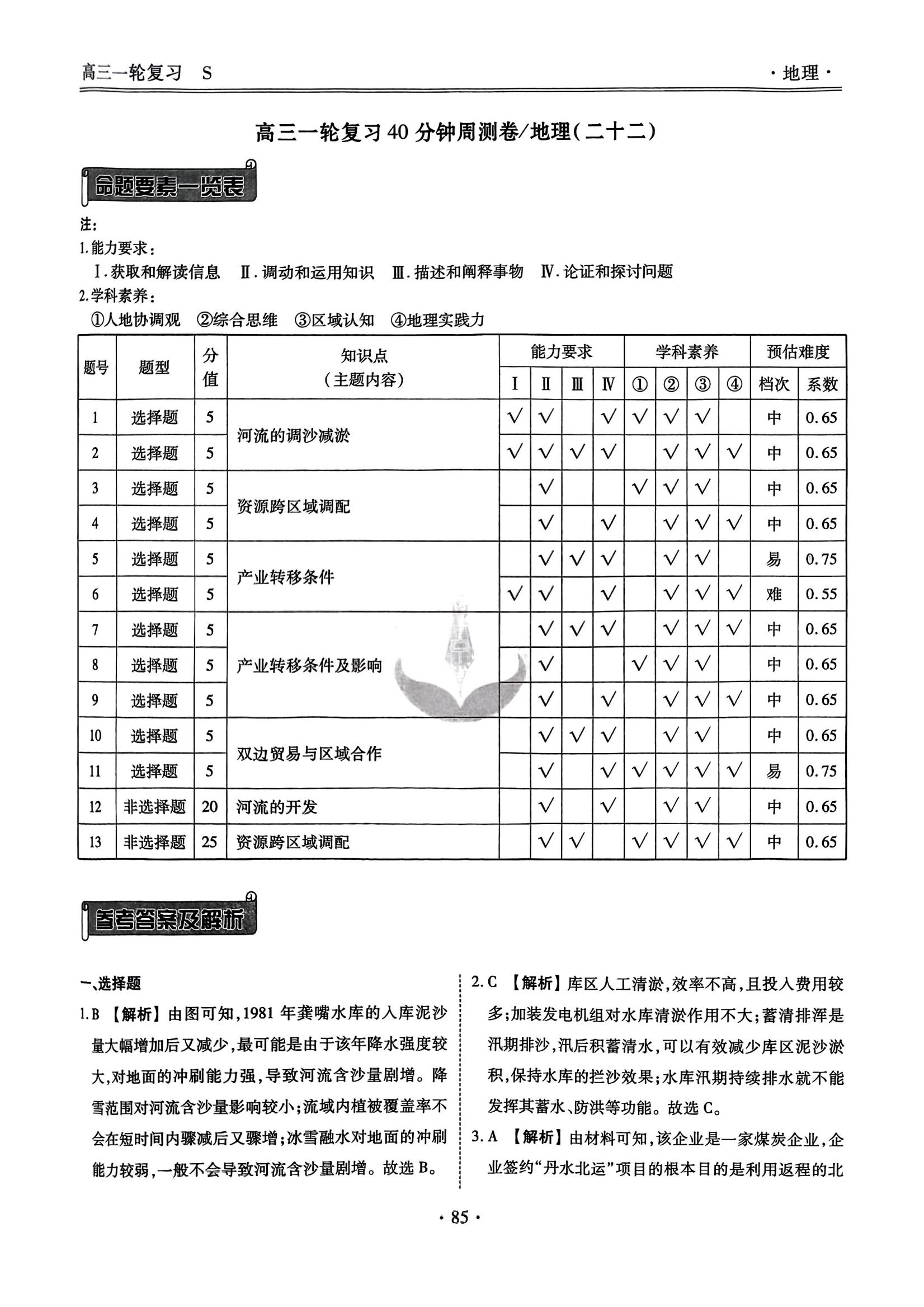
11.(20分)
I.(1)Cu+2H₂SO₄(浓)一CuSO₄+SO₂个十
2H₂O(3分)
(2)防止C中的溶液倒吸人A中(或防倒吸)(2分)
(3)SO₂+OH-—HSO₃(2分)
Ⅱ.(4)对照实验1.实验2在NaHSO₃中加人NaCl并没有产生明显的电流,说明NaCl并未改变HSO₄的还原性,所以a不合理(3分)(5)①10 mL 1 mol/L CuSO₄溶液和2g NaCI固体(3分)②Cu²++e +CI-—CuCl↓(3分)③存在平衡:HSO₃+2Cu²++H₂O=2Cu +SO+3H+,Cl-与Cu形成沉淀,从而降低了该反应的产物浓度,使平衡正向移动,促使反应进行(4分)
【解析】I.(1)A中铜和浓硫酸反应制取二氧化硫,化学方程式为Cu+2H₂SO₄(浓)=CuSO₄+SO₂个+2H₂O。(2)装置B为安全瓶,防止C中的溶液倒吸入A中。(3)二氧化硫与氢氧化钠溶液反应制备NaHSO₃的离子方程式为SO₂+OH-—HSO₃。Ⅱ.(4)对照实验1,实验2在NaHSO₃中加入NaCl并没有产生明显的电流,说明NaCl并未改变HSO₃的还原性,所以假设a不合理。(5)①要证明假设b合理,在其他条件均不变的情况下,在CuSO₄溶液附近添加氯化钠固体,使两极溶液区别于实验1、2,补全电化学装置示意图,A:10 mL1 mol/L NaHSO₃溶液、B:10 mL 1mol/LCuSO₄溶液和2g NaCl固体。②B中电极附近Cu²+被还原,转变为CuCl,说明Cu²+得电子发生还原反应生成CuCl,电极反应式为Cu²++e⁻+Cl-——CuCl↓。③存在平衡:HSO₃+2Cu²++H₂O=2Cu++SO²-+3H+,Cl-与Cu+形成沉淀,从而降低了该反应的产物浓度,使平衡正向移动,促使反应进行。12.(20分)(1)①D→C→B(2分)②品红溶液褪色(1分)③2H₂S+SO₂——3S↓+2H₂O(3分)④5SO₂+2MnO+2H₂O—5SO²-+2Mn²++
4H+(3分)(2)①1000 mL容量瓶、胶头滴管(2分)②防止二氧化硫被空气中的O₂氧化(2分)③H₂O₂不稳定、易分解,会影响吸收效果(2分)SO₂+H₂O₂—2H⁺+SO-(3分)④600(2分)
【解析】(1)①由实验装置图可知,装置A中干山药粉末与70%较浓硫酸反应制备二氧化硫,装置D中盛有的品红溶液用于验证二氧化硫的漂白性,装置C中盛有的H₂S溶液用于验证二氧化硫的氧化性,装置B中盛有的高锰酸钾溶液用于验证二氧化硫的还原性,装置E中盛有的氢氧化钠溶液用于吸收未反应的二氧化硫,防止污染空气,则依次检验二氧化硫的漂白性、氧化性和还原性时,装置的连接顺序为A→D→C→B→E。
②预测D中出现的现象为品红溶液褪色。
③C中发生反应的化学方程式为2H₂S+SO₂—
3S↓+2H₂O。
④B中反应的离子方程式为5SO₂+2MnO4+2H₂O5SO²-+2Mn²++4H+。
(2)①用NaOH固体配制1000 mL
0.0100 mol·L→¹NaOH溶液,还需要的仪器:1000 mL容量瓶、胶头滴管。
②先通N2再加磷酸的目的:防止二氧化硫被空气中的Oz氧化。
③3%H₂O₂溶液需要现配现用,原因为H₂O₂不稳定,易分解,会影响吸收效果等;加入的过氧化氢溶液可以将+4价S元素氧化至+6价,发生的氧化还原反应的离子方程式:SO₂+H₂O₂=2H-+SO2-
④根据反应可得关系:SO₂~H₂SO₄~2NaOH,则干山药粉末10.0g中含二氧化硫质量:m(SO₂)=0.5×0.01mol·L-¹×18.75×10⁻³L×64g·mol⁻¹=0.006g=6 mg,即600 mg·kg⁻¹。

2026年40分钟周测卷衡水金卷历史H2试卷答案,真题+模拟双加持,考点覆盖超全面,备考选它准没错!吃透这套卷,考试少走弯,成绩提升看得见!
